FUNÇÕES INORGÂNICAS
Funções inorgânicas à são aquelas constituídas por todos os demais elementos químicos que constituem os ácidos, bases, sais e óxidos, estudados pela química inorgânica. A química mineral ou inorgânica abrange o estudo dos metaloides e dos metais e das combinações químicas, tem composição qualitativa, que varia muito de um para outro elemento. As principais funções químicas inorgânicas – ácidos, bases, sais e óxidos – são encontradas em nosso cotidiano e também em nosso organismo.
· Por exemplo:
O ácido clorídrico é um dos constituintes do suco gástrico, encontrado no estômago; a soda cáustica é constituinte de produto de uso doméstico para desentupir pias é utilizado para fabricar o sabão, o sal de cozinha é constituído pelo cloreto de sódio e a cal viva, utilizado na construção civil e também na culinária, é constituída pelo óxido de cálcio.
AS PRINCIPAIS FUNÇÕES INORGÂNICAS: Ácidos, Bases, Sais e Óxidos.
Imagine-se chegando a um supermercado e todos os itens das prateleiras estivessem sem nenhuma organização: massas misturadas com bebidas, produtos de limpeza e higiene, carnes, verduras e assim por diante. Com certeza você demoraria horas e horas para encontrar o produto desejado.
Essa ilustração nos ajuda a entender como a organização em grupos com características semelhantes é importante e facilita a vida das pessoas.
 Na Química se dá o mesmo. Com o passar do tempo e com a descoberta de milhares de substâncias inorgânicas, os cientistas começaram a observar que alguns desses compostos podiam ser agrupados em famílias com propriedades semelhantes. Esses grupos são chamados de funções.
Na Química se dá o mesmo. Com o passar do tempo e com a descoberta de milhares de substâncias inorgânicas, os cientistas começaram a observar que alguns desses compostos podiam ser agrupados em famílias com propriedades semelhantes. Esses grupos são chamados de funções.Na Química Inorgânica as quatro funções principais são: ácidos, bases, sais e óxidos. As primeiras três funções são definidas segundo o conceito de Arrhenius.
Vejamos quais são os compostos que compreendem cada grupo:
1. Ácidos: São compostos covalentes que reagem com água (sofrem ionização), formando soluções que apresentam como único cátion o hidrônio, H3O1+ (ou, conforme o conceito original e que permanece até hoje para fins didáticos, o cátion H1+).
Exemplos:
H2SO4 → H3O1+ + HSO4- ou H2SO4 → H1+ + HSO4-
HCl → H3O1+ + Cl1- ou HCl → H1+ + Cl1-
1.1 Ácidos principais: Ácido Sulfúrico (H2SO4), Ácido Fluorídrico (HF), Ácido Clorídrico (HCl), Ácido Cianídrico (HCN), Ácido Carbônico (H2CO3), Ácido fosfórico (H3PO4), Ácido Acético (H3CCOOH) e Ácido Nítrico (HNO3).
2. Bases: São compostos capazes de se dissociar na água liberando íons, mesmo em pequena porcentagem, dos quais o único ânion é o hidróxido, OH1-.
Exemplos:
NaOH(s) → Na1+ + OH1-
Ca(OH)2 → Ca2+ + 2 OH1-
2.1 Bases principais: Hidróxido de sódio (NaOH), Hidróxido de cálcio (Ca(OH)2), Hidróxido de magnésio(Mg(OH)2) e Hidróxido de amônio (NH4OH).
3. Sais: São compostos capazes de se dissociar na água liberando íons, mesmo em pequena porcentagem, dos quais pelo menos um cátion é diferente de H3O1+ e pelo menos um ânion é diferente de OH1-.
Exemplos:
NaCl → Na1+ + Cl1-Ca(NO3)2 → Ca2+ + 2NO31-(NH4)3PO4→ 3 NH4+1 + PO43-
3.1 Sais principais: Cloreto de Sódio (NaCl), Fluoreto de sódio (NaF), Nitro de sódio (NaNo3), Nitrato de amônio (NH4NO3), carbonato de sódio (Na2CO3), Bicarbonato de sódio (NaHCO3), Carbonato de cálcio (CaCO3), sulfato de cálcio (CaSO4), Sulfato de magnésio (MgSO4), Fosfato de cálcio (Ca3(PO4)2) e Hipoclorito de sódio (NaClO).
4. Óxidos: São compostos binários (formados por apenas dois elementos químicos), dos quais o oxigênio é o elemento mais eletronegativo.
Exemplos:
4.1 Principais óxidos: CO2, SO2, SO3, P2O5, Cl2O6, NO2, N2O4, Na2O, etc.
4.1.1 Óxidos básicos: Óxido de cálcio (CaO) e Óxido de magnésio (MgO).
4.1.2 Óxidos ácidos: Dióxido de carbono (CO2);
4.1.3 Peróxido: Peróxido de Hidrogênio (H2O2).
PRINCIPAIS ÁCIDOS, BASES, ÓXIDOS E SAIS E SUAS APLICAÇÕES.
ÁCIDOS
Ácido Clorídrico (HCl)--> O HCl impuro é comercializado com o nome de ácido muriático e é utilizado principalmente na limpeza de pisos ou de superfíceis metálicas antes da soldagem. O HCl é um componente do suco gástrico, conferindo a ele um pH adequado para a ação das enzimas digestivas gástricas.
Ácido Fluorídrico (HF) --> O HF tem a propriedade de corroer o vidro; por isso, é usado para fazer gravações em vidros e cristais.
Ácidos Sulfúrico (H2SO4) --> É utilizado nas baterias de automóvel, na fabricação de corantes, tintas, explosivos e papel; é tambem usado na indústria de fertilizantes agrícolas, permitindo a fabricação de produtos como o sulfato de amônio.
Ácido Nítrico (HNO3) --> É usado na fabricação de explosivos como o trinitrotolueno (TNT) e a nitroglicerina (dinamite); é muito útil para a indústria de fertilizantes agrícolas, permitindo a obtenção do salitre.
Ácido Cianídrico (HCN) --> Ácido utilizado em indústrias diversas, como nas de plásticos, acrílicos e corantes, entre outras. Mas ele tem também um destino sinistro: nos Estados Unidos, é usado nas "câmaras de gás" para executar pessoas condenadas à morte.
BASES
Hidróxido de Sódio (NaOH) --> Conhecida também como soda cáustica, essa substância também é utilizada na fabricação do sabão, de produtos para desentupir pias e ralos, na fabricação de celofane, detergentes e raiom, no processo de extração de celulose nas indústrias de papel, etc.
Hidróxido de Magnésio (Mg(OH)2) --> A suspensão aquosa dessa base é comercializada com o nome de leite de magnésia, produto utilizado como laxante e antiácido.
Hidróxido de Cálcio (Ca(OH)2) --> Conhecida como cal hidratada ou cal extinta, essa substância é usada na construção civil, na preparação de aramassa (areia + cal) e na caiação (pintura a cal); as indústrias açucareiras utilizavam o hidróxido de cálcio na purificação do açúcar comum.
Hidróxido de Amônio(NH4OH) --> Essa substância é obtida em solução aquosa do gás de amônia e comercializada como amoníaco. É usado na fabricação de produtos de limpeza doméstica, na revelação de filmes fotográficos, em detergentes, na inústria têxtil, etc.
Hidróxido de Potássio (KOH) --> Conhecida como potassa cáustica, é usada para alvejamento, na fabricação de sabões moles e no processamento de certos alimentos.
SAISCloreto de Sódio (NaCl) --> Este sal é intensamente usado na alimentação e também na conservação de certos alimentos; além disso, é um dos componentes do soro caseiro, usado na combate à desidratação. No sal de cozinha, além do cloreto de sódio existe uma pequena quantidade de iodeto de sódio (Nal) e de potássio (Kl). Isso previne o organismo contra o bócio ou "papo", doença que se caracteriza por um crescimento exagerado da glândula tireóide, quando a alimentação é deficiente em sais de iodo.
Fluoreto de Sódio (NsF) --> É um sal usado na fluoretação da água potável e como produto anticárie, na confecção de pasta de dente.
Nitrato de Sódio (NaNO3) --> Conhecido como salitre do Chile, esse sal é um dos adubos (fertilizantes) nitrogenados mais comuns.
Bicarbonato de Sódio (NaHCO3) --> É usado em medicamentos que atuam como antiácidos estomacais. É também empregado como fermento na fabricação de pães, bolos, etc., uma vez que libera gás carbônico aquecido. o gás carbônico permite o crescimento da massa. É, ainda, usado para fabricar extintores de incêndio de espuma.
Carbonato de Cálcio (CaCO3) --> Componente do mármore, é usado na confecção de pisos, pias, etc. O carbonato de cálcio (calcário) é também empregado na fabricação do vidro comum e do cimento.
Sulfato de Cálcio (CaSO4) --> É um sal usado na fabricação do giz e do gesso de porcelana.
OXIDOSÓxido de Cálcio (CaO) --> Obtido a partir da decomposição do calcário, é usado na agricultura para diminuir a acidez do solo e também na preparação de argamassa na construção civil.
Óxido Nitroso (N2O) --> Conhecido como gás hilariante, esse óxido inalado em pequena quantidade provoca euforia, mas pode causar sérios problemas de saúde; é utilizado como anestésico.
Dióxido de Enxofre (SO2) --> É usado para a obtenção de ácido sulfúrico e no branqueamento de óleos alimentícios, entre outras aplicações. É um dos principais poluentes atmosféricos; em dias úmidos, combina-se com o vapor de água da atmosfera e origina a chamada chuva ácida.
Monóxido de Carbono (CO) --> Usado para obter certos produtos químicos e na metalurgia do aço. É normalmente o principal poluente da atmosfera das zonas urbanas; inalado combina com a hemoglobina das hemácias do sangue, neutralizando-as para o transporte de gás oxigênio no organismo.
IMPORTÂNCIA DAS BASES
- Hidróxido de sódio ou soda cáustica (NaOH)
- É a base mais importante da indústria e do laboratório. É fabricado e consumido em grandes quantidades.
- É usado na fabricação do sabão e glicerina:
(óleos e gorduras) + NaOH ® glicerina + sabão
- É usado na fabricação de sais de sódio em geral. Exemplo: salitre.
HNO3 + NaOH ® NaNO3 + H2O
- É usado em inúmeros processos industriais na petroquímica e na fabricação de papel, celulose, corantes, etc.
- É usado na limpeza doméstica. É muito corrosivo e exige muito cuidado ao ser manuseado.
- É fabricado por eletrólise de solução aquosa de sal de cozinha. Na eletrólise, além do NaOH, obtêm-se o H2 e o Cl2, que têm grandes aplicações industriais.
- Hidróxido de cálcio (Ca(OH)2)
- É a cal hidratada ou cal extinta ou cal apagada.
- É obtida pela reação da cal viva ou cal virgem com a água. É o que fazem os pedreiros ao preparar a argamassa:
- É consumido em grandes quantidades nas pinturas a cal (caiação) e no preparo da argamassa usada na alvenaria.
- Amônia (NH3) e hidróxido de amônio (NH4OH)
- Hidróxido de amônio é a solução aquosa do gás amônia. Esta solução é também chamada de amoníaco.
- A amônia é um gás incolor de cheiro forte e muito irritante.
- A amônia é fabricada em enormes quantidades na indústria. Sua principal aplicação é a fabricação de ácido nítrico.
- É também usada na fabricação de sais de amônio, muito usados como fertilizantes na agricultura. Exemplos: NH4NO3, (NH4)2SO4, (NH4)3PO4
- A amônia é usada na fabricação de produtos de limpeza doméstica, como Ajax, Fúria, etc.
- Hidróxido de magnésio (Mg(OH)2)
- É pouco solúvel na água. A suspensão aquosa de Mg(OH)2 é o leite de magnésia, usado como antiácido estomacal. O Mg(OH)2 neutraliza o excesso de HCl no suco gástrico.
Mg(OH)2 + 2HCl ® MgCl2 + 2H2O
- Hidróxido de alumínio (Al(OH)3)
- É muito usado em medicamentos antiácidos estomacais, como Maalox, Pepsamar, etc.
OS SAIS NO COTIDIANO
Quando falamos em sal, no cotidiano, logo nos lembramos daquele condimento fundamental da cozinha, o qual é responsável pelo sabor salgado dos alimentos: o cloreto de sódio.
Contudo, na química, o termo sal tem uma definição mais ampla. "Sal", para os químicos, é todo o composto capaz de se dissociar em água liberando íons, mesmo que em pequena porcentagem, dos quais pelo menos um cátion é diferente de H+ e pelo menos um ânion é diferente de OH-.
O sal encontrado em nossa cozinha é o cloreto de sódio (NaCl), conhecido também como sal marinho ou sal-gema.
Está presente em grande quantidade no sal de cozinha, que é obtido a partir da evaporação da água do mar. Na crosta terrestre, é encontrado em jazidas, constituindo o sal-gema.
Tem papel importante na retenção de líquidos, sendo esse o motivo pelo qual se administra soro fisiológicoou soro caseiro, que o contêm, para repor perdas de água no organismo humano. É utilizado na alimentação, como tempero e para a conservação de carnes e peixes, e na fabricação de xampus e soda cáustica.
Contudo, o sal de cozinha não é um "sal", pois ele não é constituído apenas por cloreto de sódio, mas também, segundo a lei brasileira, deve ter um teor igual ou superior a 40 miligramas até o limite máximo de 100 miligramas de iodo por quilograma de cloreto de sódio. Como não é possível identificar visualmente a diferença entre cloreto de sódio e iodo, dizemos que o sal de cozinha é uma mistura homogênea.
Nitrato de sódio (NaNO3)
Fabricado a partir da amônia (NH3), é conhecido como salitre-do-chile. Pode ser utilizado na alimentação, como substituto do sal de cozinha, e tem emprego destacado na fabricação de fertilizantes.
Também é obtido de depósito de caliche, ou pode ser preparado por reação de ácido nítrico com hidróxido de sódio ou carbonato de sódio. Era antes usado na produção de ácido nítrico por aquecimento com ácido sulfúrico concentrado.
Carbonato de sódio (Na2CO3)
É um pó branco que endurece e se agrega quando exposto ao ar devido à formação de hidratos. O carbonato de sódio pode ser produzido por cristalização adequada de seus depósitos naturais (trona; natro; ranksita; pirsonita e gailussita).
Apresenta-se na forma sólida e é conhecido por barrilha ou soda. É utilizado na fabricação de vidro, sabão, fotografias, tratamento têxtil, medicamentos e no tratamento de água de piscina, para redução de acidez.
Hidrogenocarbonato de sódio (Na2CO3)
Conhecido comercialmente como bicarbonato de sódio, é um pó branco que por aquecimento perde gás carbônico. Muito usado em bebidas e sais efervescentes, como fermento químico, como reagente de laboratório, na eletrodeposição de ouro e platina, em curtumes; no tratamento de lã e da seda; em extintores de incêndio; como antiácido em Medicina (por ingestão); na cerâmica; para preservação da manteiga e de madeiras.
Pode ser produzido por reação de dióxido de carbono com hidróxido de sódio líquido.
Hipoclorito de sódio (NaClO)
O Hipoclorito de Sódio é obtido pelo borbulhamento de Cloro em solução de Hidróxido de Sódio. O produto apresenta-se como solução aquosa alcalina, contendo cerca de 13% de Hipoclorito de Sódio (NaClO), com coloração amarelada e odor característico. É comercializado nesta forma a granel e transportado em carros-tanque.
O Hipoclorito de Sódio tem propriedades oxidantes, branqueantes e desinfetantes, servindo para inúmeras aplicações, tais como: branqueamento de celulose e têxteis, desinfecção de água potável, tratamento de efluentes industriais, tratamento de piscinas, desinfecção hospitalar, produção de água sanitária, lavagem de frutas e legumes, além de agir como intermediário na produção de diversos produtos químicos.
Carbonato de cálcio (CaCO3)
É um sólido branco, que é pouco solúvel na água. O carbonato de cálcio decompõe-se por aquecimento formando-se óxido de cálcio (cal viva) e dióxido de carbono.
Ocorre na natureza como os minerais calcita e aragonita. As rochas contendo carbonato de cálcio dissolvem-se lentamente sob a ação de chuvas ácidas (contendo CO2 dissolvido) provocando dureza temporária.
É constituinte do mármore e do calcário. É utilizado na fabricação de vidro e cimento, em cremes dentais ─ por sua capacidade abrasiva ─ e como redutor da acidez de solos.
Sulfato de cálcio (CaSO4)
um composto sólido branco. Ocorre na natureza como mineral anidrita, que tem uma estrutura rômbica, mudando para monoclínica a 200 oC. Mais vulgarmente é encontrado como composto dihidratado, gesso, CaSO4.2H2O.
O sulfato de cálcio é parcialmente solúvel na água e é uma causa da dureza permanente da água. É usado na produção de certos tipos de tintas, cerâmicas e papel. Na medicina tem aplicação em ortopedia, para imobilizações. As formas que ocorrem na natureza são usadas na produção de ácido sulfúrico.
Fosfato de cálcio (Ca3(PO4)2)
É um pó branco insolúvel, Ca3(PO4)2; de densidade = 3,14.
Encontra-se na natureza no mineral apatita e também em rochas fosfato. É também o principal constituinte dos ossos dos animais.
O fosfato de cálcio pode também ser preparado pela mistura de soluções contendo íons de cálcio na presença de uma base. É usado extensivamente como fertilizante. O composto foi primeiramente chamado de ortofosfato de cálcio.
TABELA DE pH e COMO FUNCIONA?
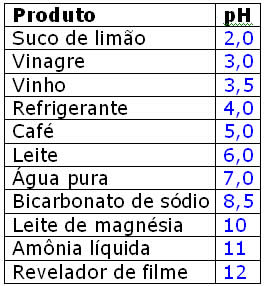 O que é pH?
O que é pH?
O pH ou potencial de hidrogénio iónico, é um índice que indica a acidez, neutralidade ou alcalinidade de um meio. O conceito foi introduzido por S. P. L. Sørensen em 1909. O "p" deriva do alemão potenz, que significa poder de concentração, e o "H" é para o ião de hidrogénio (H+).
Às vezes é referido do latim pondus hydrogenii. O "p" equivale ao simétrico do logaritmo de base 10 da actividade dos iões a que se refere, ou seja:
pH = - log10 [H+]
em que [H+] representa a concentração de iões H+ expressa em mol/dm3
O que é uma escala de pH?
O carácter ácido de uma solução está relacionado com a concentração de iões H+ presente nessa solução (quanto mais forte é um ácido, maior é a concentração desses iões na solução).
A escala de pH é uma maneira de indicar a concentração de H+ numa solução.
Esta escala varia entre o valor mínimo 0 (acidez máxima), e o máximo 14 (acidez mínima ou basicidade máxima).
A 25 ºC uma solução neutra tem um valor de pH = 7.
Para que serve a escala de pH ? |
É uma escala de valores que serve para determinar o grau de acidez ou de basicidade de uma dada substância. Varia entre 0 e 14, sendo o valor médio, o sete, correspondente a soluções neutras. Para valores superiores a 7 as soluções são consideradas básicas, e para valores inferiores a 7, serão ácidas.
|
Como medir o valor do pH ? |
|
 O pH pode ser determinado usando um medidor de pH (também conhecido como pHmetro) que consiste em um eléctrodo acoplado a um potenciómetro. O medidor de pH é um milivoltímetro com uma escala que converte o valor de potencial do eléctrodo em unidades de pH. Este tipo de eléctrodo é conhecido como eléctrodo de vidro, que na verdade, é um eléctrodo do tipo "ião selectivo". O pH pode ser determinado usando um medidor de pH (também conhecido como pHmetro) que consiste em um eléctrodo acoplado a um potenciómetro. O medidor de pH é um milivoltímetro com uma escala que converte o valor de potencial do eléctrodo em unidades de pH. Este tipo de eléctrodo é conhecido como eléctrodo de vidro, que na verdade, é um eléctrodo do tipo "ião selectivo".
O pH pode ser determinado indiretamente pela adição de um indicador de pH na solução em análise. A cor do indicador varia conforme o pH da solução. Indicadores comuns são a fenolftaleína, o alaranjado de metilo e o azul de tornassol.
Outro indicador de pH muito usado em laboratórios é o chamado papel de tornassol (papel de filtro impregnado com tornassol). Este indicador apresenta uma ampla faixa de viragem, servindo para indicar se uma solução é nitidamente ácida (quando ele fica vermelho) ou nitidamente básica (quando ele fica azul). Utiliza-se ainda em grande escala, o papel indicador universal, que é uma mistura de indicadores de pH, normalmente em solução ou secos em tiras de papel absorvente, que apresentam distintas cores para cada pH de 1 a 14. Tabelas com cores padrões do produto para os pH medidos são fornecidos com as tiras, para que se possa determinar o valor de pH, por comparação da tabela com a cor obtida na tira embebida na solução a analisar.
Obs.: Embora o valor do pH compreenda uma faixa de 0 a 14 unidades, estes não são os limites para o pH. É possível valores de pH acima e abaixo desta faixa, como exemplo, uma solução que fornece pH = -1,00, apresenta matematicamente -log [H+] = -1,00, ou seja, [H+] = 10 mol L?1. Este é um valor de concentração facilmente obtido em uma solução concentrada de um ácido forte, como o HCl.
Erros de medida com um medidor de pH (eléctrodo) |
Há vários tipos de erros que podem ocorrer nas medidas do pH ocasionados por diversos factores, entre eles, destacam-se: - Erros dos padrões de calibração: Uma medida de pH não pode apresentar uma precisão maior que aquela dos padrões de referência disponíveis, apresentando erros da ordem de ±0,01 unidades de pH;
- Erro do potencial de junção: Há um potencial de junção na membrana que separa o meio interno do externo do eléctrodo. Se a composição iónica entre estes diferentes meios (interno e externo) apresenta-se muito distante da composição da solução tampão padrão utilizada na calibração do eléctrodo, o potencial de junção é modificado, ocasionando variações nas medidas de pH em torno de 0,01 unidades;
- Erro do deslocamento do potencial de junção: A grande maioria dos eléctrodos combinados possuem um eléctrodo de referência de prata-cloreto de prata que contém no seu interior, uma solução saturada de KCl. Tendo em vista a alta concentração de iões cloreto no interior do eléctrodo, esta possibilita, em contacto com o eléctrodo de prata, a formação de AgCl43- e AgCl32-. Na membrana porosa de vidro do eléctrodo, que separa as soluções interna e externa, a concentração de iões cloreto é menor (KCl está diluído), o que favorece a precipitação do AgCl. Se a solução do analito a ser medido conter um agente redutor, pode ocorrer ainda a precipitação de Ag(s) na própria membrana. Estes efeitos modificam o potencial de junção provocando um deslocamento lento do valor de pH no visor do instrumento durante um período grande de tempo. Tais erros podem ser corrigidos pela calibração do eléctrodo a cada 2 h.
- Erro do sódio (erro alcalino): Quando a concentração de iões H+ é baixa e a concentração de Na+ é alta, o eléctrodo responde ao Na+ como se este fosse o H+ e o pH medido torna-se menor que o pH verdadeiro.
- Erro ácido: Em ácidos fortes, o valor do pH medido torna-se maior que o pH verdadeiro, devido à saturação de iões H+ na superfície da membrana de vidro do eléctrodo. Isto ocorre devido à saturação dos sítios activos da membrana de vidro do eléctrodo.
- Erro no tempo para atingir o equilíbrio: As medidas de pH geralmente são obtidas após algum tempo de contacto do eléctrodo com a solução de interesse. Numa solução bem tamponada, sob agitação adequada, este tempo de espera fica em torno de 30 segundos. Numa solução mal tamponada (por exemplo, próxima ao ponto de equivalência de uma titulação) necessita de um tempo maior para atingir o equilíbrio.
- Erro de hidratação do vidro: Um eléctrodo hidratado apresenta uma resposta adequada às variações de pH, enquanto que um eléctrodo seco, necessita ser hidratado por várias horas antes de ser realizada uma medida.
- Erro de temperatura: As medições de pH necessariamente devem ser realizadas na mesma temperatura em que ocorreu sua calibração.
|
CHUVA ÁCIDA: GOTAS DE DESTRUIÇÃO
O que é Chuva Ácida?
A chuva ácida é uma das principais consequências da poluição do ar. As queimas de carvão ou de derivados de petróleo liberam resíduos gasosos, como óxidos de nitrogênio e de enxofre. A reação dessas substâncias com a água forma o ácido nítrico e o ácido sulfúrico, presentes nas precipitações de chuva ácida.
1 - A origem da chuva ácida está na fumaça que as chaminés das fábricas e os escapamentos dos carros lançam na atmosfera. A queima de petróleo e carvão libera gases poluentes — entre eles o dióxido de enxofre, os óxidos de nitrogênio e o monóxido de carbono, compostos tóxicos que servem como matéria-prima para as gotas de chuva nocivas 2 - Nem sempre a tempestade cai no mesmo lugar em que os poluentes foram liberados, porque as correntes de vento podem transportar os gases tóxicos por mais de 2 mil quilômetros. Isso explica como o arquipélago das Bermudas, no Caribe, ou as montanhas amazônicas do sul da Venezuela, onde não há indústrias, sofrem tanto com a chuva ácida 3 - Durante o transporte, os gases poluentes entram em contato com o vapor d’água e com os gases que compõem a atmosfera, como o oxigênio e o nitrogênio. Estimulados pela energia solar, esses compostos vão reagir e gerar as substâncias que compõem a chuva ácida 4 - As reações fazem com que o ar apresente uma concentração elevada de compostos ácidos, principalmente de ácido sulfúrico e ácido nítrico. Quando chove, as gotas levam esses ácidos do ar para a terra. Nos casos mais graves, o nível de acidez na chuva pode ser superior ao de um suco de limão!
Vamos as Consequências:
Esse tipo de precipitação agride florestas, mata a vida aquática e torna solos improdutivos.
PREJUÍZO HISTÓRICO: Como as gotas ácidas destroem objetos de calcário, mármore e cobre, alguns monumentos sofrem forte corrosão. A acidez é tão poderosa que rompe até mesmo as camadas de resina que protegem as pinturas dos carros, fazendo a carroceria enferrujar.
VERDE CORROÍDO: Em contato com a vegetação das florestas, as gotas ácidas queimam as folhas das plantas, produzindo manchas amareladas e pequenos buracos. Com isso, reduz-se a capacidade da árvore de obter energia por meio da fotossíntese. As plantas passam a crescer mais lentamente e raramente atingem seu tamanho normal
TERRA ARRASADA: No solo, a chuva ácida dissolve os principais nutrientes das plantas e carrega-os na enxurrada. Pior: a acidez das gotas libera alumínio e cádmio, compostos tóxicos para plantas e animais do local AMEAÇA À SAÚDE: Para o homem, ficar molhado em uma tempestade ácida ou nadar em um lago ácido pode deixar a pele bem ressecada, mas não oferece maiores riscos. O problema são os poluentes que originam o fenômeno: se inalados por muito tempo, eles causam náusea, dor de cabeça e doenças respiratórias graves BANHO PERIGOSO: Os lagos ácidos chegam a ter acidez superior à do vinagre, afetando toda a vida aquática. Os mais atingidos são os peixes: espécies sensíveis, como a truta, desaparecem rápido. No nordeste dos Estados Unidos, existem lagos ácidos sem um único peixe
EFEITO ESTUFA E OS ÓXIDOS
O Efeito Estufa é a forma que a Terra tem para manter sua temperatura constante. A atmosfera é altamente transparente à luz solar, porém cerca de 35% da radiação que recebemos vai ser refletida de novo para o espaço, ficando os outros 65% retidos na Terra. Isto deve-se principalmente ao efeito sobre os raios infravermelhos de gases como o Dióxido de Carbono, Metano, Óxidos de Azoto e Ozônio presentes na atmosfera (totalizando menos de 1% desta), que vão reter esta radiação na Terra, permitindo-nos assistir ao efeito calorífico dos mesmos.
Nos últimos anos, a concentração de dióxido de carbono na atmosfera tem aumentado cerca de 0,4% anualmente; este aumento se deve à utilização de petróleo, gás e carvão e à destruição das florestas tropicais. A concentração de outros gases que contribuem para o Efeito de Estufa, tais como o metano e os clorofluorcarbonetos também aumentaram rapidamente. O efeito conjunto de tais substâncias pode vir a causar um aumento da temperatura global (Aquecimento Global) estimado entre 2 e 6 ºC nos próximos 100 anos. Um aquecimento desta ordem de grandeza não só irá alterar os climas em nível mundial como também irá aumentar o nível médio das águas do mar em, pelo menos, 30 cm, o que poderá interferir na vida de milhões de pessoas habitando as áreas costeiras mais baixas.
Se a terra não fosse coberta por um manto de ar, a atmosfera, seria demasiado fria para a vida. As condições seriam hostis à vida, a qual de tão frágil que é, bastaria uma pequena diferença nas condições iniciais da sua formação, para que nós não pudessemos estar aqui discutindo-a . O Efeito Estufa consiste, basicamente, na ação do dióxido de carbono e outros gases sobre os raios infravermelhos refletidos pela superfície da terra, reenviados para ela, mantendo assim uma temperatura estável no planeta. Ao irradiarem a Terra, parte dos raios luminosos oriundos do Sol são absorvidos e transformados em calor, outros são refletidos para o espaço, mas só parte destes chega a deixar a Terra, em consequência da ação refletora que os chamados "Gases de Efeito Estufa" (dióxido de carbono, metano, clorofluorcarbonetos- CFCs- e óxidos de azoto) têm sobre tal radiação reenviando-a para a superfície terrestre na forma de raios infravermelhos. Desde a época pré-histórica que o dióxido de carbono tem tido um papel determinante na regulação da temperatura global do planeta. Com o aumento da utilização de combustíveis fósseis (Carvão, Petróleo e Gás Natural) a concentração de dióxido de carbono na atmosfera duplicou nos últimos cem anos. Neste ritmo e com o abatimento massivo de florestas que se tem praticado (é nas plantas que o dióxido de carbono, através da fotossíntese, forma oxigênio e carbono, que é utilizado pela própria planta) o dióxido de carbono começará a proliferar levando, muito certamente, a um aumento da temperatura global, o que, mesmo tratando-se de poucos graus, levaria ao degelo das calotes polares e a grandes alterações a nível topográfico e ecológico do planeta.
EXPERIMENTO
Resumo |
Esse experimento mostra de modo simples como construir uma escala para distinguir entre substâncias ácidas e básicas. O experimento consiste em construir uma escala de pH utilizando extrato de repolho-roxo e outros materiais de fácil acesso. |
Objetivos |
O objetivo da atividade consiste em realizar um experimento que explique o que são substâncias ácidas e básicas. Para tanto, será construída uma escala de pH utilizando como indicador ácido-base o extrato de repolho-roxo para medir o pH de substâncias usadas no dia-a-dia. |
Material |
Materiais Utilizados
· 18 tubos de ensaio · 2 Béqueres de 250mL · Béquer de 500mL · Agitador magnético com aquecimento · Aventais de manga longa (um para cada integrante do grupo) · Repolho roxo · Vinagre · Álcool · Detergente com amoníaco · Detergente liquido · Xampu · Leite · Suco de limão · Solução aquosa de sabão em pó · Clara de ovo · Comprimido efervescente Os tubos de ensaio podem ser substituídos por copos de vidro ou descartáveis transparente, os béqueres podem ser substituídos por panelas e o agitador magnético com aquecimento pode ser substituído por um fogão e colheres para agitar. Para se obter água destilada, basta ferver água potável. |
Procedimento |
1. Preparação de extrato de repolho roxo e escala padrão de pH Para fazer a extração do pigmento do repolho roxo devem ser feitos os seguintes passos: o Colocar uma pequena quantidade de repolho roxo num béquer de 250 mL; o Adicionar água destilada até cobrir todo o repolho roxo; o Ferver a mistura até reduzir o volume de água; o Filtrar a mistura e guardar o líquido filtrado.
Em seguida fazer a escala padrão de pH, para isso devemos: o Rotular 5 tubos de ensaio e adicionar as soluções da tabela abaixo;
Tubo de ensaio | Solução |
1 | 5 mL de água destilada + 5 de gotas de vinagre + 5 mL de solução de repolho roxo |
2 | 5 mL de álcool + 5 mL de solução de repolho roxo |
3 | 5 mL de água destilada + 5 mL de solução de repolho roxo |
4 | 5 mL de água destilada + 1 gota de detergente com amoníaco + 5 mL de solução de repolho roxo |
5 | 5 mL de água destilada + 5 gotas de detergente com amoníaco + 5 mL de solução de repolho roxo |
2. Teste de pH em diferentes substâncias Para fazer o teste de pH devemos realizar os seguintes passos: o Rotular 6 tubos de ensaio; o Acrescentar 5 mL de água destilada e 5 mL de solução de repolho roxo em cada tubo de ensaio; o Em cada tubo acrescentar 5 gotas das seguintes substâncias:
Tubo de ensaio | Solução acrescentada |
1 | Xampu |
2 | Leite |
3 | Suco de limão |
4 | Detergente liquido |
5 | Solução aquosa de sabão em pó |
6 | Clara de ovo |
o Depois classificar as substâncias como ácidos fortes ou fracos e bases fortes ou fracas; o E se possível fazer uma escala de pH entre as substâncias analisadas. |
RESUMINDO, O QUE QUEREMOS TE EXPLICAR É QUE:
Funções Inorgânicas:
Como em tudo na ciência, as substâncias inorgânicas foram divididas em quatro panelas grupos, onde os compostos com certas características parecidas, como a atração por elétrons são colocados juntinhos. As quatro funções inorgânicas que fazem parte desta panela são: Compostos conhecidos por terem H no começo da fórmula, são os que adoram brigar com as bases. Nunca deixam de lado um arranca-rabo e, muitos deles, se entrarem em contato com a pele, queimam até o osso sem dó. No entanto, o seu corpo é cheio deles, ou tu acha que o que tem no estômago é só água? .
Compostos onde o oxigênio é o parzinho do outro átomo, sendo que apenas dois elementos podem estar neste casamento. O oxigênio não permite nenhum tipo de traição e/ou enrolação com outros átomos. Esse grupo é muito conhecido por brigar com a água e criar, ou ácidos, ou bases. Os poucos que são assexuados neutros, se comportam como os Gases Nobres, embora não façam parte da zelite.
O que sobrou do arranca-rabo entre o ácido e a base, o sal é o filhote da reação dos dois grupos já citados. Representantes muito utilizados desse grupo são o cloreto de sódio e o sal de fruta.
REFERÊNCIAS:


 É a fase que pagamos todos aqueles “micos”… Tudo por culpa da noraepinefrina (Fig.3) (ou noradrenalina) que acelera os batimentos cardíacos (excitação), a serotonina (Fig.4) que nos descontrola e causa aquela euforia, e a dopamina (Fig. 5) conhecida também, como hormônio da alegria.
É a fase que pagamos todos aqueles “micos”… Tudo por culpa da noraepinefrina (Fig.3) (ou noradrenalina) que acelera os batimentos cardíacos (excitação), a serotonina (Fig.4) que nos descontrola e causa aquela euforia, e a dopamina (Fig. 5) conhecida também, como hormônio da alegria.  A feniletilamina é muito importante em todo o processo, pois controla a passagem da fase da paixão para a fase do amor, dessa maneira exerce um grande poder sobre nós, tão poderosa que pode tornar-se viciante. Os viciados em feniletilamina (e seus auxiliares) tendem a ser pessoas instáveis no amor e costumam trocar de parceiro assim que o efeito daquele “combo químico” desaparece.
A feniletilamina é muito importante em todo o processo, pois controla a passagem da fase da paixão para a fase do amor, dessa maneira exerce um grande poder sobre nós, tão poderosa que pode tornar-se viciante. Os viciados em feniletilamina (e seus auxiliares) tendem a ser pessoas instáveis no amor e costumam trocar de parceiro assim que o efeito daquele “combo químico” desaparece.
 Acontece que essa sensação pode não durar muito tempo, neste ponto os casais têm a impressão que o amor esfriou. Com o passar do tempo o organismo vai se acostumando e adquirindo resistência, passa a necessitar de doses cada vez maiores de substâncias químicas para provocar as mesmas sensações do início.
Acontece que essa sensação pode não durar muito tempo, neste ponto os casais têm a impressão que o amor esfriou. Com o passar do tempo o organismo vai se acostumando e adquirindo resistência, passa a necessitar de doses cada vez maiores de substâncias químicas para provocar as mesmas sensações do início.












